


Next: Ecuación de Estado para
Up: Termodinámica
Previous: Expansión Térmica
Podemos realizar experimentos controlados y determinar cómo depende el volumen de otras
cantidades termodinámicas.
Si hacemos un diseño experimental que nos permita mantener la temperatura y presión constantes,
pero variando la cantidad de gas (el número de moléculas), encontraremos que para distintos gases
la relación 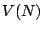 es lineal, esto es,
es lineal, esto es,
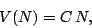 |
(6) |
donde 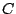 es una constante; esto se conoce como la Ley de Avogadro.
Si ahora mantenemos
es una constante; esto se conoce como la Ley de Avogadro.
Si ahora mantenemos 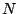 y
y 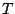 constantes, y variamos la presión, encontraremos que el gas satisface la Ley de Boyle:
constantes, y variamos la presión, encontraremos que el gas satisface la Ley de Boyle:
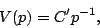 |
(7) |
donde 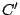 es otra constante. Si mantenemos ahora
es otra constante. Si mantenemos ahora 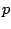 y
y 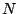 constantes, variando la temperatura,
encontraremos que
constantes, variando la temperatura,
encontraremos que
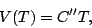 |
(8) |
donde 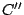 es otra constante, es decir, la Ley de Gay-Lussac o de Charles.
es otra constante, es decir, la Ley de Gay-Lussac o de Charles.
Willians Barreto
2006-04-24
![]() es lineal, esto es,
es lineal, esto es,